En el mundo del laboratorio, uno de los parámetros más medidos, ajustados y controlados es el pH.
Desde una simple disolución acuosa hasta un cultivo celular, el valor del pH determina cómo se comportan las moléculas, cómo reaccionan las sustancias y, en muchos casos, si un experimento tendrá éxito o no.
El pH no es solo un número en una escala: es una medida del equilibrio químico del agua y de cómo los iones hidrógeno (H⁺) afectan la estructura y función de la materia.
Comprenderlo es esencial tanto para químicos y biólogos, como para analistas, farmacéuticos y técnicos de laboratorio.
Qué es el pH
El término pH proviene del francés “pouvoir hydrogène”, que significa “potencial de hidrógeno”.
En química, se define como:
pH=−log[H+]\text{pH} = -\log [H^+]
donde [H+][H^+] es la concentración molar de iones hidrógeno en una disolución.
Esta ecuación indica que el pH mide la acidez o basicidad (alcalinidad) de una sustancia.
-
Si hay muchos iones H⁺, la disolución es ácida (pH bajo).
-
Si hay pocos iones H⁺ y predominan los iones hidroxilo (OH⁻), es básica o alcalina (pH alto).
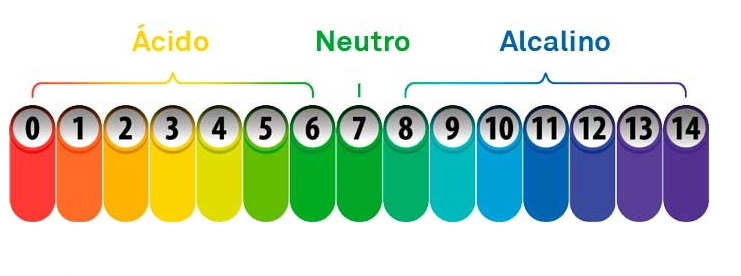
La escala de pH
La escala de pH va de 0 a 14 y es logarítmica, lo que significa que cada unidad representa un cambio de diez veces en la concentración de H⁺.
| Valor de pH | Tipo de disolución | Ejemplo |
|---|---|---|
| 0 – 3 | Muy ácida | Ácido clorhídrico, jugo gástrico |
| 4 – 6 | Ligeramente ácida | Vinagre, refrescos |
| 7 | Neutra | Agua pura |
| 8 – 10 | Ligeramente básica | Agua jabonosa |
| 11 – 14 | Muy básica | Lejía, hidróxido de sodio |
Un cambio de una sola unidad de pH equivale a una diferencia de diez veces en la acidez o basicidad.
Importancia del pH en química
En química, el pH afecta directamente la velocidad, el equilibrio y la dirección de las reacciones.
Muchas reacciones solo ocurren en rangos específicos de pH.
Ejemplos:
-
En una titulación ácido-base, el punto de equivalencia se detecta justamente por el cambio de pH.
-
En la síntesis química, un pH incorrecto puede causar degradación, precipitación o descomposición de reactivos.
-
En el análisis químico, medir el pH permite identificar impurezas o variaciones en la composición de una muestra.
Además, el pH influye en la solubilidad de las sustancias: ciertos compuestos precipitan en medios ácidos y otros en básicos, lo que puede alterar por completo los resultados experimentales.
Importancia del pH en biología
En los sistemas biológicos, el pH regula la actividad enzimática, la estructura de las proteínas, el metabolismo celular y la función de las membranas.
Cada organismo, tejido o enzima tiene un pH óptimo en el que trabaja de forma eficiente.
Ejemplos:
-
La enzima pepsina, en el estómago, actúa mejor a pH 2.
-
La amilasa salival trabaja alrededor de pH 7.
-
La tripsina intestinal requiere un ambiente más alcalino (pH 8).
Un cambio leve en el pH puede inhibir o desnaturalizar proteínas, alterar la respiración celular o incluso provocar la muerte celular.
Por eso, los tampones biológicos o soluciones buffer son fundamentales en laboratorios de biología molecular, microbiología y bioquímica.
Cómo se mide el pH en el laboratorio
Existen diversos métodos para medir el pH, dependiendo del grado de precisión requerido:
1. Indicadores y papel tornasol
-
Son métodos cualitativos o semicuantitativos.
-
Cambian de color según la acidez o basicidad de la solución.
-
Útiles para ensayos rápidos o demostraciones didácticas.
2. pH-metros digitales
-
Equipos de alta precisión, que miden el potencial eléctrico generado por los iones H⁺ mediante un electrodo de vidrio.
-
Requieren calibración previa con soluciones patrón de pH 4, 7 y 10.
3. Electrodos específicos o mini-electrodos
-
Ideales para muestras pequeñas o viscosas, como cultivos celulares o alimentos.
Cómo influye el pH en los experimentos de laboratorio
-
Reacciones químicas controladas:
Ajustar el pH garantiza que la reacción ocurra en la dirección deseada y a la velocidad adecuada. -
Cultivos microbianos:
Cada microorganismo tiene un rango de pH óptimo. Si el medio se acidifica o alcaliniza demasiado, el crecimiento se detiene. -
Purificación de proteínas y ADN:
Los procedimientos como la electroforesis o la precipitación de ácidos nucleicos dependen fuertemente del pH. -
Análisis de aguas y alimentos:
El pH se usa como indicador de contaminación, frescura y estabilidad química. -
Fabricación de medicamentos:
El pH afecta la solubilidad y estabilidad de los principios activos y excipientes.
Soluciones buffer o tampón: el control del pH
Una solución buffer o tampón es una mezcla que mantiene el pH constante incluso al añadir pequeñas cantidades de ácido o base.
Por ejemplo, una solución de ácido acético y acetato de sodio actúa como tampón alrededor de pH 4.7.
En biología, los tampones más comunes son:
-
PBS (Phosphate Buffered Saline): usado en cultivos celulares.
-
Tris-HCl: mantiene pH entre 7.0 y 9.0.
-
HEPES: excelente para sistemas biológicos sensibles a la temperatura.
Buenas prácticas al medir pH
-
Calibrar el pH-metro antes de cada sesión de trabajo.
-
Lavar el electrodo con agua destilada entre mediciones.
-
No dejar el electrodo secar (mantenerlo en solución de almacenamiento).
-
Evitar introducir el electrodo en soluciones calientes o muy concentradas.
Estas precauciones garantizan mediciones precisas, reproducibles y seguras.
Preguntas frecuentes (FAQ)
1. ¿Qué significa un pH menor a 7?
Indica que la solución es ácida, es decir, tiene una concentración alta de iones H⁺.
2. ¿El pH puede ser menor que 0 o mayor que 14?
Sí, en soluciones muy concentradas o especiales. La escala 0–14 aplica solo a soluciones acuosas diluidas.
3. ¿Por qué cambia el pH de una solución con el tiempo?
Por reacciones químicas con el CO₂ del aire, evaporación o degradación de los componentes.
4. ¿Qué es un pH óptimo?
Es el valor de pH en el que una reacción o sistema biológico funciona de manera más eficiente.
5. ¿Cuál es la diferencia entre pH y pOH?
El pOH mide la concentración de iones hidroxilo (OH⁻) y está relacionado con el pH mediante la ecuación:
pH+pOH=14pH + pOH = 14
El pH es uno de los parámetros más fundamentales en cualquier laboratorio.
Su control adecuado permite asegurar la precisión experimental, la estabilidad de los compuestos y la viabilidad de los sistemas biológicos.
Desde una simple titulación hasta un complejo experimento molecular, el pH actúa como un termómetro químico invisible, que determina si las condiciones del medio son las adecuadas para que la ciencia funcione.
Comprender qué es el pH, cómo medirlo y cómo mantenerlo controlado es una habilidad esencial para todo profesional o estudiante del laboratorio moderno.