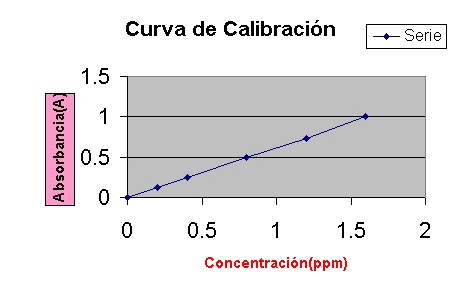
La curva de calibración es una herramienta esencial en el análisis químico cuantitativo, utilizada para determinar la concentración desconocida de una sustancia mediante la relación entre una señal instrumental (como la absorbancia, la intensidad o el voltaje) y concentraciones conocidas de un estándar.
En pocas palabras, una curva de calibración permite convertir una señal experimental en un valor numérico confiable, lo que garantiza resultados precisos y reproducibles en el laboratorio.
Este procedimiento es ampliamente usado en espectrofotometría, cromatografía, electroquímica y análisis volumétrico, entre otros campos. En este artículo aprenderás cómo construir, analizar e interpretar correctamente una curva de calibración en laboratorio químico, paso a paso.
¿Qué es una curva de calibración?
Una curva de calibración (también llamada gráfica de calibración o curva patrón) es la representación gráfica de la respuesta analítica de un instrumento frente a una serie de concentraciones conocidas de una sustancia patrón.
El eje X (horizontal) representa la concentración, mientras que el eje Y (vertical) representa la señal medida (por ejemplo, la absorbancia en un espectrofotómetro).
A partir de esta gráfica se obtiene una ecuación de regresión lineal:
y=mx+by = m x + b
donde:
-
y = señal medida (absorbancia, intensidad, etc.),
-
x = concentración del analito,
-
m = pendiente (sensibilidad del método),
-
b = intercepto o error sistemático.
Una vez construida la curva, cualquier muestra desconocida puede analizarse midiendo su señal y calculando su concentración a partir de la ecuación obtenida.
Importancia de la curva de calibración
Realizar correctamente una curva de calibración garantiza:
-
Exactitud y precisión en los resultados.
-
Trazabilidad frente a patrones certificados.
-
Control de calidad en instrumentos analíticos.
-
Detección de errores sistemáticos o desviaciones del método.
Se considera una de las prácticas más importantes en laboratorios químicos, farmacéuticos, ambientales y de alimentos.
Pasos para realizar una curva de calibración en laboratorio
A continuación, se describen los pasos generales para la elaboración de una curva de calibración, tomando como ejemplo un análisis por espectrofotometría UV-Visible.
Paso 1: Preparación de la solución patrón
-
Pesar una cantidad exacta del analito puro (por ejemplo, sulfato de cobre o permanganato de potasio).
-
Disolver en un volumen conocido de solvente (generalmente agua destilada).
-
Preparar una solución madre de concentración conocida (por ejemplo, 100 mg/L).
Paso 2: Preparación de las soluciones estándar
A partir de la solución madre, se preparan soluciones diluidas con diferentes concentraciones conocidas, por ejemplo:
10, 20, 30, 40 y 50 mg/L.
Estas servirán como los puntos de referencia para construir la curva.
Paso 3: Medición de la señal analítica
Cada solución estándar se analiza con el instrumento correspondiente:
-
En espectrofotometría, se mide la absorbancia a una longitud de onda específica.
-
En cromatografía, se mide el área del pico.
-
En electroquímica, se mide la intensidad de corriente.
Los resultados se registran en una tabla:
| Concentración (mg/L) | Absorbancia (A) |
|---|---|
| 10 | 0.10 |
| 20 | 0.19 |
| 30 | 0.30 |
| 40 | 0.39 |
| 50 | 0.51 |
Paso 4: Construcción de la curva
-
Graficar la absorbancia (eje Y) frente a la concentración (eje X).
-
Trazar la mejor línea recta posible (ajuste lineal).
-
Calcular la ecuación de la recta y el coeficiente de correlación (R²).
Ejemplo:
A=0.0102C+0.002,R2=0.999A = 0.0102C + 0.002, \quad R² = 0.999
Un valor de R² cercano a 1 indica una buena linealidad y, por tanto, una calibración confiable.
Paso 5: Determinación de la muestra desconocida
Se mide la absorbancia de la muestra problema (por ejemplo, 0.35) y se sustituye en la ecuación de la recta:
C=A−bm=0.35−0.0020.0102=34.1 mg/LC = \frac{A – b}{m} = \frac{0.35 – 0.002}{0.0102} = 34.1 \, \text{mg/L}
Así se obtiene la concentración desconocida del analito.
Paso 6: Validación de la curva de calibración
Antes de dar por válida una curva, se deben evaluar los siguientes parámetros:
-
Linealidad: el rango en el que la señal es proporcional a la concentración.
-
Límite de detección (LOD) y límite de cuantificación (LOQ).
-
Repetibilidad y precisión de las mediciones.
-
Verificación con estándares de control.
Factores que afectan la curva de calibración
-
Errores en la preparación de soluciones.
-
Contaminación de material volumétrico.
-
Desalineación del instrumento.
-
Temperatura y pH de la muestra.
-
Uso de reactivos vencidos o de baja pureza.
Controlar estos factores es fundamental para obtener una curva estable y reproducible.
Ejemplo práctico: curva de calibración para hierro (Fe²⁺)
Objetivo: Determinar la concentración de hierro en agua mediante espectrofotometría UV-Vis.
-
Preparar una solución patrón de Fe²⁺ con sulfato ferroso (FeSO₄·7H₂O).
-
Reaccionar con 1,10-fenantrolina para formar un complejo coloreado.
-
Medir absorbancia a 510 nm.
-
Trazar la curva y obtener:
A=0.0053C+0.001,R2=0.998A = 0.0053C + 0.001, \quad R² = 0.998
Muestra: absorbancia = 0.32 → concentración = 60.3 mg/L de Fe²⁺.
Interpretación y conclusiones
Una curva de calibración correctamente construida:
-
Permite obtener resultados cuantitativos exactos.
-
Valida la sensibilidad del método.
-
Facilita la comparación entre diferentes instrumentos o laboratorios.
Además, su elaboración desarrolla en los analistas habilidades críticas en control de calidad y validación de métodos analíticos, pilares de todo laboratorio químico moderno.
Preguntas frecuentes (FAQ)
1. ¿Por qué es importante la linealidad en una curva de calibración?
Porque garantiza que la respuesta del instrumento sea proporcional a la concentración, evitando errores de interpretación.
2. ¿Cuántos puntos debe tener una curva de calibración?
Generalmente entre 5 y 7 puntos, distribuidos de forma uniforme en el rango de interés.
3. ¿Qué hacer si el R² es menor a 0.995?
Revisar la preparación de los estándares o el rango de concentración; puede haber desviaciones no lineales.
4. ¿La curva se debe realizar cada vez que se hace un análisis?
Depende del instrumento. Algunos requieren recalibración diaria o semanal, especialmente en espectrofotometría o cromatografía.
5. ¿Puedo usar una curva de calibración para diferentes analitos?
No. Cada sustancia tiene su propia respuesta instrumental y requiere su curva específica.
La curva de calibración es el corazón de los análisis cuantitativos en laboratorio. Su correcta elaboración garantiza precisión, exactitud y trazabilidad, valores esenciales en química analítica.
Entender su fundamento, control de errores y aplicación práctica convierte a los analistas en verdaderos profesionales de la medición científica.