En la mayoría de los experimentos de laboratorio, el pH de las soluciones juega un papel crucial. Un cambio mínimo en este valor puede alterar reacciones químicas, afectar la actividad enzimática o modificar la estructura de proteínas y ácidos nucleicos.
Para mantener el pH estable frente a la adición de ácidos o bases, se utilizan las soluciones tampón, también conocidas como buffers. Estas mezclas químicas actúan como “amortiguadores” del pH, garantizando condiciones controladas y reproducibles durante los ensayos.
En este artículo aprenderás qué es una solución tampón, su composición, cómo funciona, ejemplos comunes y cómo preparar una correctamente en el laboratorio químico o biológico.
¿Qué es una solución tampón?
Una solución tampón es una mezcla formada por un ácido débil y su base conjugada, o por una base débil y su ácido conjugado, que resiste los cambios de pH cuando se añaden pequeñas cantidades de ácido o base fuerte.
Estas soluciones mantienen el pH casi constante, lo que resulta esencial en reacciones químicas sensibles, cultivos celulares, análisis clínicos y estudios bioquímicos.
Ejemplo básico:
Un tampón clásico es el ácido acético (CH₃COOH) con su sal acetato de sodio (CH₃COONa).
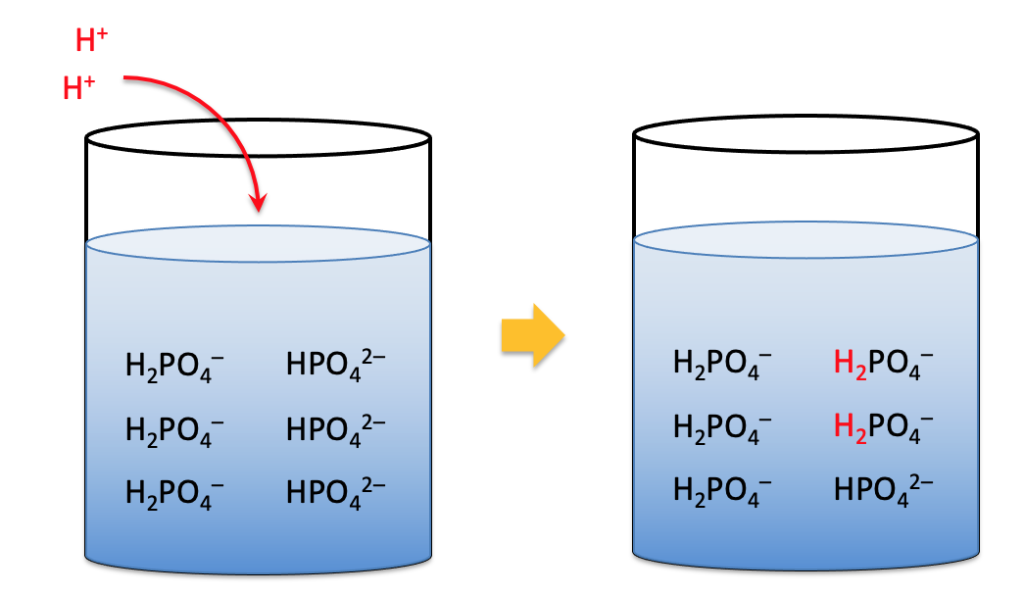
Cuando se añade un ácido o base, el equilibrio entre ambos componentes se ajusta, minimizando el cambio en la concentración de iones H⁺.
CH3COOH⇌H++CH3COO−CH₃COOH \rightleftharpoons H^+ + CH₃COO^-
Composición de una solución tampón
Toda solución tampón está compuesta por:
-
Un ácido débil (HA): que puede donar protones (H⁺).
-
Su base conjugada (A⁻): que puede captar protones (H⁺).
Ejemplo de tampón ácido:
-
Ácido acético (CH₃COOH) / acetato (CH₃COONa).
Ejemplo de tampón básico:
-
Amoníaco (NH₃) / cloruro de amonio (NH₄Cl).
El equilibrio entre ambos componentes se explica por la ecuación de Henderson-Hasselbalch:
pH=pKa+log([A−][HA])pH = pK_a + \log \left(\frac{[A^-]}{[HA]}\right)
Esta fórmula permite calcular el pH del tampón a partir del pKa del ácido y las concentraciones de la pareja ácido-base.
Función principal de una solución tampón
La función de una solución tampón es mantener estable el pH de una disolución, incluso cuando se agregan pequeñas cantidades de ácidos o bases fuertes.
En el laboratorio, esto es fundamental para:
-
Evitar la desnaturalización de proteínas en experimentos bioquímicos.
-
Controlar el pH en reacciones enzimáticas.
-
Garantizar condiciones fisiológicas en cultivos celulares.
-
Estabilizar soluciones estándar en análisis químicos.
Ejemplo de acción:
Si a un tampón acético/acetato se le agrega HCl, el ion acetato (CH₃COO⁻) neutraliza los protones:
CH3COO−+H+→CH3COOHCH₃COO^- + H^+ \rightarrow CH₃COOH
El resultado: el pH apenas cambia.
Capacidad amortiguadora
La capacidad amortiguadora (β) es la habilidad de una solución tampón para resistir cambios de pH.
Depende de:
-
Las concentraciones del ácido y su base conjugada.
-
La cercanía del pH al valor de pKa.
Un tampón es más efectivo cuando pH ≈ pKa, generalmente dentro de un rango de ±1 unidad.
Ejemplos de soluciones tampón comunes
| Nombre del tampón | Composición | Rango de pH efectivo | Aplicación principal |
|---|---|---|---|
| Ácido acético / Acetato de sodio | CH₃COOH / CH₃COONa | 3.8 – 5.8 | Química general, biología |
| Amoníaco / Cloruro de amonio | NH₃ / NH₄Cl | 8.5 – 10.5 | Bioquímica, microbiología |
| Tampón fosfato | H₂PO₄⁻ / HPO₄²⁻ | 6.0 – 8.0 | Biología celular, PCR, buffers fisiológicos |
| Tampón Tris | Tris / Tris-HCl | 7.0 – 9.0 | Electroforesis, biología molecular |
| Tampón bicarbonato | H₂CO₃ / HCO₃⁻ | 6.3 – 7.4 | Sistemas biológicos, sangre humana |
Cómo preparar una solución tampón en el laboratorio
🔹 Paso 1: Seleccionar el ácido y su base conjugada
Elige una pareja cuyo pKa esté cerca del pH deseado.
Por ejemplo, para mantener un pH de 7.4, se puede usar un tampón fosfato (pKa ≈ 7.2).
🔹 Paso 2: Calcular las concentraciones
Usa la ecuación de Henderson-Hasselbalch para determinar la proporción de las especies:
[A−][HA]=10(pH−pKa)\frac{[A^-]}{[HA]} = 10^{(pH – pK_a)}
Por ejemplo, si deseas preparar un tampón acético a pH 5.0 y el pKa del ácido acético es 4.76:
[A−][HA]=10(5.0−4.76)=1.74\frac{[A^-]}{[HA]} = 10^{(5.0 – 4.76)} = 1.74
Esto significa que la concentración del acetato debe ser 1.74 veces mayor que la del ácido acético.
🔹 Paso 3: Preparación práctica
-
Disolver las cantidades necesarias del ácido y la sal en un matraz volumétrico.
-
Ajustar el volumen con agua destilada.
-
Medir el pH con un potenciómetro y ajustar si es necesario con HCl o NaOH diluidos.
-
Etiquetar y almacenar correctamente el tampón.
Ejemplo práctico: Tampón fosfato (pH 7.4)
-
Mezclar 50 mL de NaH₂PO₄ 0.1 M con 50 mL de Na₂HPO₄ 0.1 M.
-
Verificar el pH (debe estar cerca de 7.4).
-
Ajustar ligeramente con NaOH o H₃PO₄ si es necesario.
Aplicaciones de las soluciones tampón
Las soluciones tampón son indispensables en:
-
Biología molecular: PCR, electroforesis, purificación de proteínas.
-
Química analítica: titulación potenciométrica y espectrofotometría.
-
Medicina: mantenimiento del equilibrio ácido-base en sangre (sistema bicarbonato).
-
Farmacia: formulación de medicamentos estables al pH corporal.
-
Medio ambiente: análisis de aguas y suelos.
Errores comunes al preparar una solución tampón
-
Usar concentraciones muy bajas (reduce la capacidad amortiguadora).
-
Mezclar componentes incompatibles.
-
No verificar el pH final con un potenciómetro.
-
Contaminación del agua o del material volumétrico.
-
Almacenamiento prolongado sin control de temperatura.
Preguntas frecuentes (FAQ)
1. ¿Por qué el tampón es importante en experimentos biológicos?
Porque mantiene el pH fisiológico estable, evitando la desnaturalización de proteínas y enzimas.
2. ¿Qué ocurre si el pH del tampón cambia con el tiempo?
Puede deberse a contaminación, evaporación o absorción de CO₂ del aire. Debe prepararse nuevamente.
3. ¿Un tampón puede neutralizar cualquier cantidad de ácido o base?
No, su capacidad es limitada. Una adición excesiva sobrepasa su poder amortiguador.
4. ¿Cuál es el mejor tampón para pH neutro?
El tampón fosfato y el Tris-HCl son los más utilizados en ese rango.
5. ¿Se pueden esterilizar los tampones?
Sí, mediante filtración o autoclave, dependiendo de la composición.
Las soluciones tampón son indispensables en el trabajo de laboratorio porque garantizan la estabilidad del pH, lo que permite que las reacciones químicas y biológicas se desarrollen en condiciones controladas.
Desde el simple tampón acético hasta los sistemas fosfato y Tris, su correcta preparación y aplicación reflejan la calidad técnica y el rigor experimental del laboratorio moderno.
Entender cómo funcionan y cómo prepararlas es una habilidad esencial para todo profesional de las ciencias químicas y biológicas.